ALK+ немелкоклеточный рак легкого
Диагностика
Перестройки гена ALK можно выявить в образцах опухолей или плазмы1.
ALK-тестирование можно проводить разными методами на уровнях ДНК, РНК и белка2,3:
ДНК

- Флуоресцентная гибридизация in situ (FISH)4
- Секвенирование генов (NGS)5
РНК

Полимеразная цепная реакция с обратной транскрипцией (ПЦР c ОТ)6
Белок
Иммуногистохимия (ИГХ)7
FISH
FISH был первым клиническим тестом, широко используемым для обнаружения перестройки гена ALK при НМРЛ8-11.
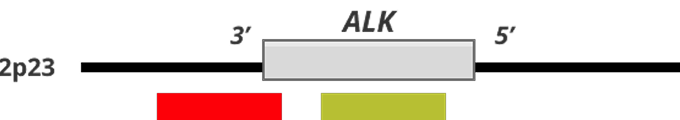
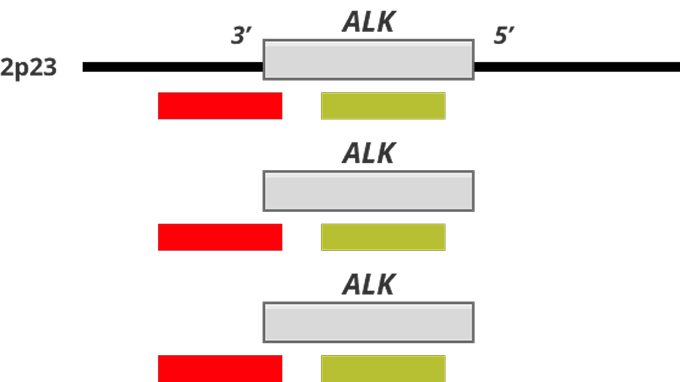
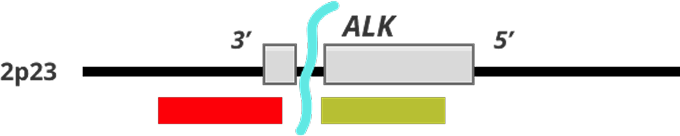
Коммерческие зонды с разрывом включают два разноцветных (красный и зеленый) зонда, которые поддерживают высококонсервативные точки прерывания транслокации в ALK
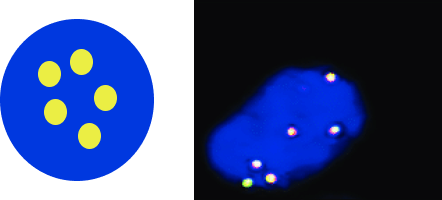
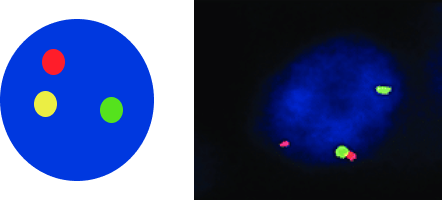
Рисунок 1. Статус гена ALK и FISH-паттерны12,13
1Клетка с диким типом ALK
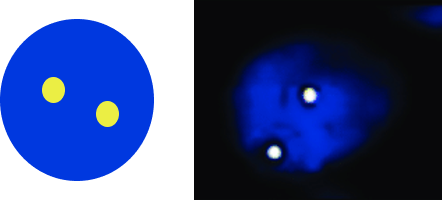
2Клетка с увеличением числа копий гена ALK
3Клетка с перестройкой ALK
A — нормальная клетка с диким типом гена ALK (без нарушений) демонстрирует паттерн из двух желтых (красно-зелёных) сигналов слияния;
B — клетка с увеличением числа копий или амплификацией гена ALK демонстрирует паттерн из 3–6 красно-зелёных сигналов слияния;
C — клетка с перестройкой гена ALK демонстрирует паттерн из одного красно-зелёного сигнала слияния, одного отдельного красного сигнала и одного отдельного зелёного сигнала.
- В неструктурированных ячейках перекрывающиеся красный и зеленый зонды приводят к сильному (плавкому) сигналу; при установке перестройки ALK-гена эти зонды разделяются, и наблюдается разделение красного и зеленого сигналов.
- Также были идентифицированы атипичные паттерны перегруппировки, которые также реагируют на ингибирование ALK14.
- Одна только амплификация гена ALK не является предиктором чувствительности к этим агентам и не имеет такого же значения, как перегруппировка.
NGS
NGS — мультигенный анализ NGS быстро стал предпочтительным вариантом по сравнению с FISH или ИГХ.
В отдельном исследовании комплексное геномное профилирование выявило перегруппировки ALK в подгруппе пациентов с НМРЛ, у которых изначально был отрицательный результат при FISH-исследовании15. Эти пациенты имели ответы на терапию ALK-ингибиторами, сопоставимые с историческими показателями ответа пациентов с ALK-положительными опухолями, определенными при FISH-исследовании.
Подробный рабочий процесс секвенирования нового поколения представлен на рисунке № 2.
Рисунок 2. Рабочий процесс при NGS16
Изоляция образца и выделение материала
Извлечение геномной ДНК пациента, свободной циркулирующей ДНК (cell-free DNA) или ДНК из формалин-фиксированных парафиновых образцов (FFPE).
Подготовка библиотеки для секвенирования
Извлечённая ДНК фрагментируется, проводится восстановление концов, затем к концам фрагментов добавляются адаптеры.
Целенаправленное обогащение
Обогащение образцов с использованием ампликонного или захватного подхода для выделения генов, ассоциированных с заболеванием, или конкретных генов интереса.
Секвенирование
Обогащённые образцы секвенируются на платформах секвенирования нового поколения.
Анализ данных
Разделение данных по образцам, выравнивание последовательностей, выявление вариантов и последующий третичный анализ.
Интерпретация и применение
Целенаправленное секвенирование помогает в постановке диагноза, прогнозировании, персонализированной медицине и выявлении редких заболеваний.
ИГХ
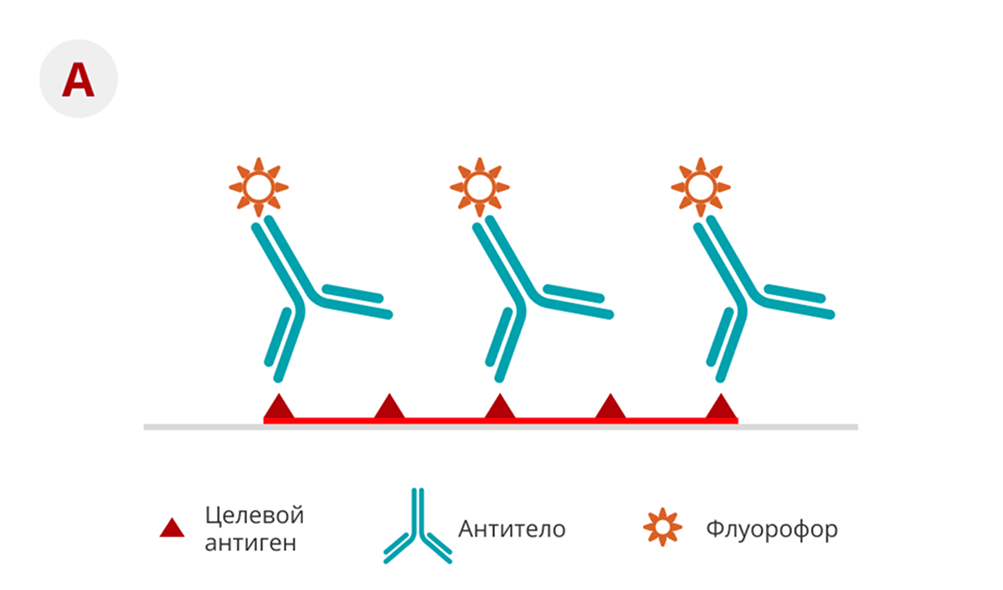
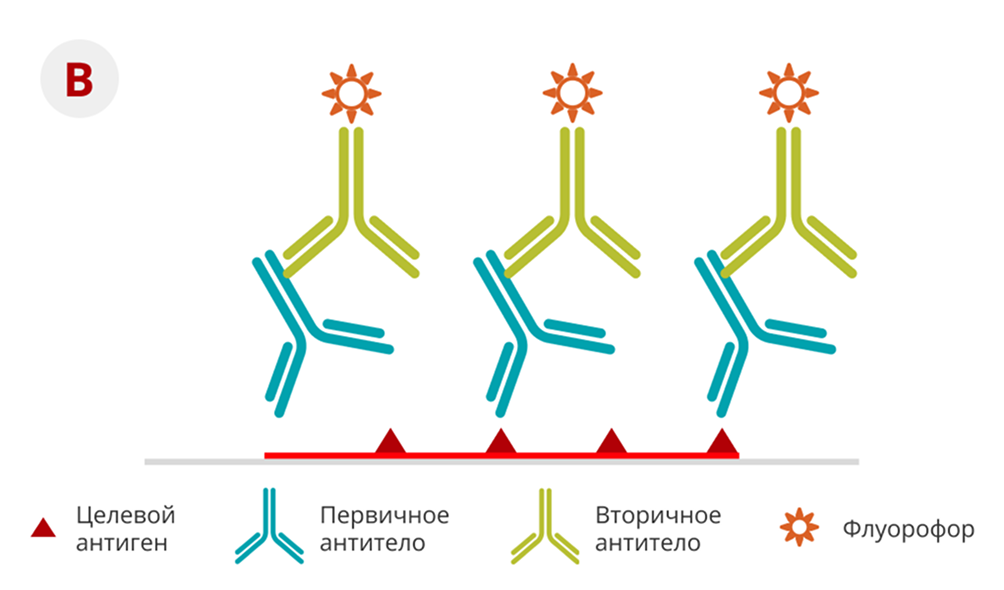
Для ИГХ-определения перестройки онкопротеина ALK было разработано множество моноклональных антител, и ИГХ с использованием этих антител является высокочувствительным и специфичным (см. рис № 3)17. Таким образом, ИГХ является подходящим методом для скрининга и определения позитивного статуса для мутации ALK-гена. Анализ CDx Ventana ALK (D5F3) был одобрен FDA для использования в Соединенных Штатах18.
Рисунок 3. Схематическое изображение прямого (A) и непрямого (B) метода ИГХ19
ОТ-ПЦР
ОТ-ПЦР — высокочувствительный и специфичный метод генетического анализа, который позволяет идентифицировать партнёра и вариант слияния ALK (см. рис № 4).
ОТ-ПЦР может использоваться только для ограниченного набора вариантов, и, в отличие от NGS, практически не обладает потенциалом выявления новых слияний (то есть не сможет определить ранее неизвестное ALK-слияние).
Преимущества метода — его доступность (оборудование имеется в большинстве лабораторий) и экономическая эффективность при небольшом числе целевых регионов (≤ 20 целей)20-22.
Рисунок 4. Схема ОТ-ПЦР

Выводы:
- Основные методы ALK-тестирования: NGS, FISH и иммуногистохимия.
- Выявление ALK-перестроек важно для назначения эффективной терапии.
Источники:
- Zugazagoitia J, Ramos I, Trigo JM, et al. Clinical utility of plasma-based digital next-generation sequencing in patients with advance-stage lung adenocarcinomas with insufficient tumor samples for tissue genotyping. Ann Oncol. 2019;30(2):290-296. doi:10.1093/annonc/mdy512
- Weickhardt AJ, Aisner DL, Franklin WA, Varella-Garcia M, Doebele RC, Camidge DR. Diagnostic assays for identification of anaplastic lymphoma kinase-positive non-small cell lung cancer. Cancer. 2013;119(8):1467-1477. doi:10.1002/cncr.27913
- Ignatius Ou SH, Azada M, Hsiang DJ, et al. Next-generation sequencing reveals a Novel NSCLC ALK F1174V mutation and confirms ALK G1202R mutation confers high-level resistance to alectinib (CH5424802/RO5424802) in ALK-rearranged NSCLC patients who progressed on crizotinib. J Thorac Oncol. 2014;9(4):549-553. doi:10.1097/JTO.0000000000000094
- Shakoori AR. Fluorescence In Situ Hybridization (FISH) and Its Applications. Chromosome Structure and Aberrations. 2017;343-367. Published 2017 Feb 10. doi:10.1007/978-81-322-3673-3_16
- Satam H, Joshi K, Mangrolia U, et al. Next-Generation Sequencing Technology: Current Trends and Advancements. Biology (Basel). 2023;12(7):997. Published 2023 Jul 13. doi:10.3390/biology12070997
- Hussaini HM, Seo B, Rich AM. Immunohistochemistry and Immunofluorescence. Methods Mol Biol. 2023;2588:439-450. doi:10.1007/978-1-0716-2780-8_26
- Rio DC. Reverse transcription-polymerase chain reaction. Cold Spring Harb Protoc. 2014;2014(11):1207-1216. Published 2014 Nov 3. doi:10.1101/pdb.prot080887
- Martelli MP, Sozzi G, Hernandez L, et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues. Am J Pathol. 2009;174(2):661-670. doi:10.2353/ajpath.2009.080755
- Boland JM, Erdogan S, Vasmatzis G, et al. Anaplastic lymphoma kinase immunoreactivity correlates with ALK gene rearrangement and transcriptional up-regulation in non-small cell lung carcinomas. Hum Pathol. 2009;40(8):1152-1158. doi:10.1016/j.humpath.2009.01.012
- Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol. 2009;27(26):4247-4253. doi:10.1200/JCO.2009.22.6993
- Perner S, Wagner PL, Demichelis F, et al. EML4-ALK fusion lung cancer: a rare acquired event. Neoplasia. 2008;10(3):298-302. doi:10.1593/neo.07878
- Kapeleris J, Kulasinghe A, Warkiani ME, et al. Ex vivo culture of circulating tumour cells derived from non-small cell lung cancer. Transl Lung Cancer Res. 2020;9(5):1795-1809. doi:10.21037/tlcr-20-521
- Ronchi A, Montella M, Cozzolino I, et al. The potential diagnostic and predictive role of anaplastic lymphoma kinase (ALK) gene alterations in melanocytic tumors. Eur Rev Med Pharmacol Sci. 2020;24(7):3829-3838. doi:10.26355/eurrev_202004_20849
- Li W, Zhang J, Guo L, Chuai S, Shan L, Ying J. Combinational Analysis of FISH and Immunohistochemistry Reveals Rare Genomic Events in ALK Fusion Patterns in NSCLC that Responds to Crizotinib Treatment. J Thorac Oncol. 2017;12(1):94-101. doi:10.1016/j.jtho.2016.08.145
- Ali SM, Hensing T, Schrock AB, et al. Comprehensive Genomic Profiling Identifies a Subset of Crizotinib-Responsive ALK-Rearranged Non-Small Cell Lung Cancer Not Detected by Fluorescence In Situ Hybridization. Oncologist. 2016;21(6):762-770. doi:10.1634/theoncologist.2015-0497
- Pei XM, Yeung MHY, Wong ANN, et al. Targeted Sequencing Approach and Its Clinical Applications for the Molecular Diagnosis of Human Diseases. Cells. 2023;12(3):493. Published 2023 Feb 2. doi:10.3390/cells12030493
- Conklin CM, Craddock KJ, Have C, Laskin J, Couture C, Ionescu DN. Immunohistochemistry is a reliable screening tool for identification of ALK rearrangement in non-small-cell lung carcinoma and is antibody dependent. J Thorac Oncol. 2013;8(1):45-51. doi:10.1097/JTO.0b013e318274a83e
- U.S. Food and Drug Administration. Premarket Approval (PMA) - P170019. Доступно по ссылке: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=p170019. Дата обращения: 30 июня 2025 года.
- Im K, Mareninov S, Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Methods Mol Biol. 2019;1897:299-311. doi:10.1007/978-1-4939-8935-5_26
- Teixidó C, Karachaliou N, Peg V, Gimenez-Capitan A, Rosell R. Concordance of IHC, FISH and RT-PCR for EML4-ALK rearrangements. Transl Lung Cancer Res. 2014;3(2):70-74. doi:10.3978/j.issn.2218-6751.2014.02.02
- Letovanec I, Finn S, Zygoura P, et al. Evaluation of NGS and RT-PCR Methods for ALK Rearrangement in European NSCLC Patients: Results from the European Thoracic Oncology Platform Lungscape Project. J Thorac Oncol. 2018;13(3):413-425. doi:10.1016/j.jtho.2017.11.117
- Adams G. A beginner’s guide to RT-PCR, qPCR and RT-qPCR. Biochem (Lond). 2020;42(3):48-53. doi:10.1042/BIO20200034
VV-MEDMAT-127273
Октябрь 2025