АЛК+ өкпенің ұсақ жасушалы емес обыры
Диагностикалау
ALK генінің транслокациясын ісік немесе плазма үлгілерінен анықтауға болады1.
ALK-тестілеу әртүрлі әдістермен ДНҚ, РНҚ және ақуыз деңгейінде жүргізілуі мүмкін2,3:
ДНҚ

- In situ флуоресценттік гибридизация (FISH)4
- Ген тізбегін анықтау (секвендеу) (NGS)5
РНҚ

Кері транскрипциялы полимеразды тізбекті реакция (КТ ПТР)6
Ақуыз
Иммуногистохимия (ИГХ)7
FISH
FISH ALK генінің транслокациясын ӨҰЖЕО кезінде анықтау үшін алғаш кеңінен қолданылған клиникалық тест болды8-11.
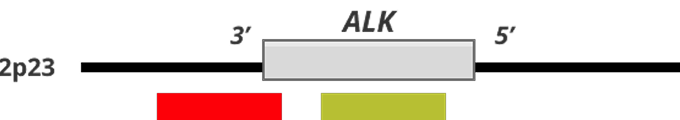
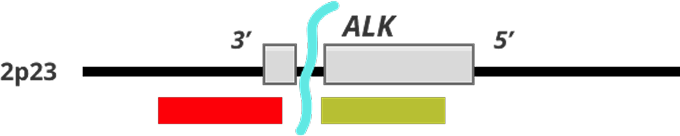
Коммерциялық брейк-зондтар ALK транслокациясының жоғары консервативті үзілу нүктелерін қамтамасыз ететін екі түрлі түсті (қызыл және жасыл) зондтан тұрады
1-сурет. ALK генінің статусы және FISH-паттерндері12,13
1Жабайы типтегі ALK бар жасуша
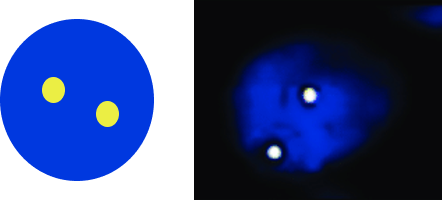
2ALK гені көшірмелерінің саны артқан жасуша
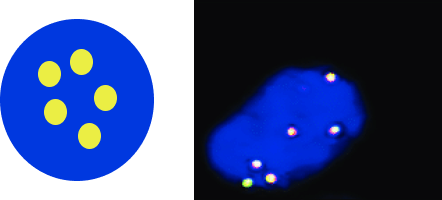
3ALK транслокациясы бар жасуша
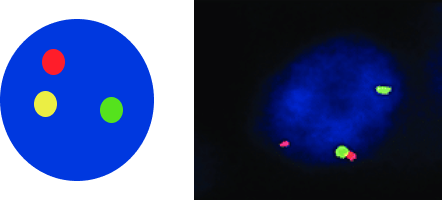
A — жабайы типті ALK гені бар (бұзылуы жоқ) қалыпты жасуша екі сары (қызыл-жасыл) бірігу белгісінен тұратын паттерн көрсетеді;
B — ALK гені көшірмелерінің саны артқан немесе амплификацияланған жасуша 3–6 қызыл-жасыл бірігу белгісінен тұратын паттерн көрсетеді;
C — ALK генінің транслокациясы бар жасуша бір қызыл-жасыл бірігу белгісін, бір бөлек қызыл белгі және бір бөлек жасыл белгіні көрсетеді.
- Реттелмеген торларда қабаттасқан қызыл және жасыл зондтар күшті (біріккен) белгі береді; ALK-генінің транслокациясы кезінде бұл зондтар ажырайды, және қызыл, жасыл белгілер айырылады.
- Сондай-ақ ALK тежегішіне жауап беретін атипиялық қайта топтасу паттерндері де анықталған14.
- Тек ALK генінің амплификациясы бұл агенттерге сезімталдықтың болжаушысы болып табылмайды және қайта топтасу (транслокация) сияқты маңызға ие емес.
NGS
NGS — мультигендік NGS талдауы FISH немесе ИГХ-ға қарағанда тез арада негізгі таңдау әдісіне айналды.
Жеке зерттеуде кешенді геномдық профилирлеу ӨҰЖЕО-мен ауыратын кейбір пациенттерде FISH талдауында бастапқыда теріс нәтиже болса да, ALK транслокациясын анықтады15. Бұл пациенттерде ALK-тежегіштерімен емдеуге жауап FISH әдісімен ALK-оң деп анықталған ісіктері бар пациенттердің тарихи жауап көрсеткіштеріне ұқсас болды.
Жаңа буын секвендеуінің толық жұмыс процесі №2 суретте көрсетілген.
2-сурет. NGS кезіндегі жұмыс барысы16
Үлгіні оқшаулау және материалды бөліп алу
Науқастың геномдық ДНҚ-сын, бос айналымдағы ДНҚ-ны (cell-free DNA) немесе формалинмен бекітілген парафинді блоктардан (FFPE) алынған ДНҚ-ны бөліп алу.
Секвендеуге деректер қорын дайындау
Бөлінген ДНҚ фрагменттеледі, ұштары қалпына келтіріледі, кейін фрагмент ұштарына адаптерлер қосылады.
Мақсатты байыту
Үлгілерді ампликонды немесе зондты әдіспен байыту — аурулармен байланысты гендерді немесе нақты қызығушылық тудыратын гендерді бөлу.
Секвендеу
Байытылған үлгілер жаңа буын секвендеу платформаларында секвенделеді.
Деректерді талдау
Деректерді үлгіге бөлу, тізбектерді реттестіру, нұсқаларды анықтау және кейінгі үшіншілік талдау.
Талдау және қолдану
Мақсатты секвендеу диагностика қоюда, болжам жасауда, дербестендірілген медицина мен сирек ауруларды анықтауда көмектеседі.
ИГХ
ALK онкопротеинінің транслокациясын анықтайтын ИГХ-ға арналған көптеген моноклоналды антиденелер жасалды, және осы антиденелерді қолданатын ИГХ жоғары сезімталдық пен ерекшелікті көрсетеді (3-суретті қараңыз)17. Осылайша, ИГХ ALK генінің мутациясына оң мәртебені скрининг жасау мен анықтаудың қолайлы әдісі болып табылады. CDx Ventana ALK (D5F3) талдауы АҚШ-та қолдануға FDA мақұлдауын алған18.
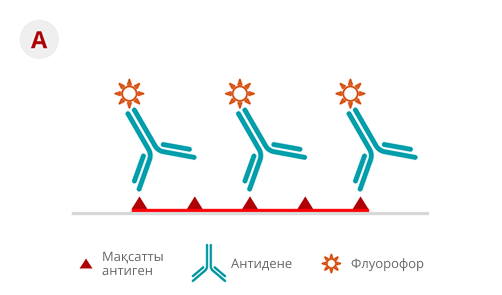
3-сурет. ИГХ-ның тікелей (A) және жанама (B) әдістерінің сызбалық көрінісі19
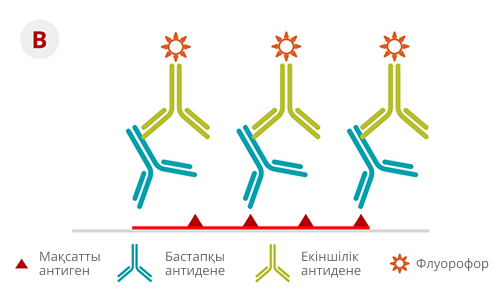
КТ-ПТР
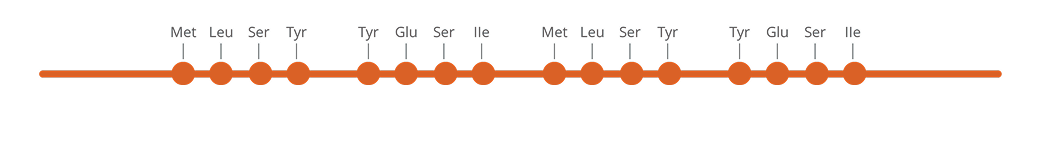
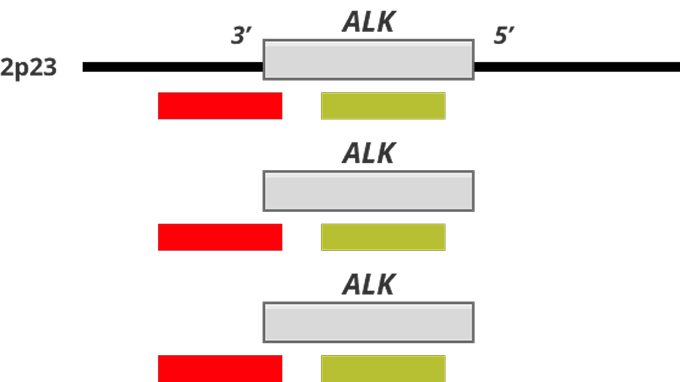
КТ-ПТР — генетикалық талдаудың жоғары сезімтал әрі ерекше әдісі, ол ALK бірігуіндегі серігін және бірігу түрін анықтауға мүмкіндік береді (4-суретті қараңыз).
КТ-ПТР тек шектеулі нұсқаларды анықтай алады, және NGS-пен салыстырғанда жаңа бірігулерді анықтау мүмкіндігі жоқ (яғни бұрын белгісіз ALK-бірігуін анықтай алмайды).
Әдістің артықшылықтары — кең қолжетімділігі (көптеген зертханаларда жабдық бар) және мақсатты аймақтардың саны аз (≤ 20 мақсат) болғанда үнемділігі20-22.
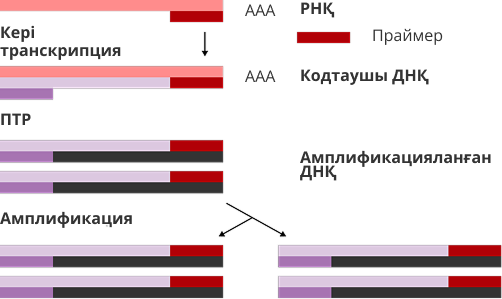
4-сурет. Схема КТ-ПТР
Қорытындылар:
- ALK-тестілеудің негізгі әдістері: NGS, FISH және иммуногистохимия.
- ALK транслокациясын анықтау тиімді терапия тағайындау үшін маңызды.
Дереккөздер:
- Zugazagoitia J, Ramos I, Trigo JM, et al. Clinical utility of plasma-based digital next-generation sequencing in patients with advance-stage lung adenocarcinomas with insufficient tumor samples for tissue genotyping. Ann Oncol. 2019;30(2):290-296. doi:10.1093/annonc/mdy512
- Weickhardt AJ, Aisner DL, Franklin WA, Varella-Garcia M, Doebele RC, Camidge DR. Diagnostic assays for identification of anaplastic lymphoma kinase-positive non-small cell lung cancer. Cancer. 2013;119(8):1467-1477. doi:10.1002/cncr.27913
- Ignatius Ou SH, Azada M, Hsiang DJ, et al. Next-generation sequencing reveals a Novel NSCLC ALK F1174V mutation and confirms ALK G1202R mutation confers high-level resistance to alectinib (CH5424802/RO5424802) in ALK-rearranged NSCLC patients who progressed on crizotinib. J Thorac Oncol. 2014;9(4):549-553. doi:10.1097/JTO.0000000000000094
- Shakoori AR. Fluorescence In Situ Hybridization (FISH) and Its Applications. Chromosome Structure and Aberrations. 2017;343-367. Published 2017 Feb 10. doi:10.1007/978-81-322-3673-3_16
- Satam H, Joshi K, Mangrolia U, et al. Next-Generation Sequencing Technology: Current Trends and Advancements. Biology (Basel). 2023;12(7):997. Published 2023 Jul 13. doi:10.3390/biology12070997
- Hussaini HM, Seo B, Rich AM. Immunohistochemistry and Immunofluorescence. Methods Mol Biol. 2023;2588:439-450. doi:10.1007/978-1-0716-2780-8_26
- Rio DC. Reverse transcription-polymerase chain reaction. Cold Spring Harb Protoc. 2014;2014(11):1207-1216. Published 2014 Nov 3. doi:10.1101/pdb.prot080887
- Martelli MP, Sozzi G, Hernandez L, et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues. Am J Pathol. 2009;174(2):661-670. doi:10.2353/ajpath.2009.080755
- Boland JM, Erdogan S, Vasmatzis G, et al. Anaplastic lymphoma kinase immunoreactivity correlates with ALK gene rearrangement and transcriptional up-regulation in non-small cell lung carcinomas. Hum Pathol. 2009;40(8):1152-1158. doi:10.1016/j.humpath.2009.01.012
- Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol. 2009;27(26):4247-4253. doi:10.1200/JCO.2009.22.6993
- Perner S, Wagner PL, Demichelis F, et al. EML4-ALK fusion lung cancer: a rare acquired event. Neoplasia. 2008;10(3):298-302. doi:10.1593/neo.07878
- Kapeleris J, Kulasinghe A, Warkiani ME, et al. Ex vivo culture of circulating tumour cells derived from non-small cell lung cancer. Transl Lung Cancer Res. 2020;9(5):1795-1809. doi:10.21037/tlcr-20-521
- Ronchi A, Montella M, Cozzolino I, et al. The potential diagnostic and predictive role of anaplastic lymphoma kinase (ALK) gene alterations in melanocytic tumors. Eur Rev Med Pharmacol Sci. 2020;24(7):3829-3838. doi:10.26355/eurrev_202004_20849
- Li W, Zhang J, Guo L, Chuai S, Shan L, Ying J. Combinational Analysis of FISH and Immunohistochemistry Reveals Rare Genomic Events in ALK Fusion Patterns in NSCLC that Responds to Crizotinib Treatment. J Thorac Oncol. 2017;12(1):94-101. doi:10.1016/j.jtho.2016.08.145
- Ali SM, Hensing T, Schrock AB, et al. Comprehensive Genomic Profiling Identifies a Subset of Crizotinib-Responsive ALK-Rearranged Non-Small Cell Lung Cancer Not Detected by Fluorescence In Situ Hybridization. Oncologist. 2016;21(6):762-770. doi:10.1634/theoncologist.2015-0497
- Pei XM, Yeung MHY, Wong ANN, et al. Targeted Sequencing Approach and Its Clinical Applications for the Molecular Diagnosis of Human Diseases. Cells. 2023;12(3):493. Published 2023 Feb 2. doi:10.3390/cells12030493
- Conklin CM, Craddock KJ, Have C, Laskin J, Couture C, Ionescu DN. Immunohistochemistry is a reliable screening tool for identification of ALK rearrangement in non-small-cell lung carcinoma and is antibody dependent. J Thorac Oncol. 2013;8(1):45-51. doi:10.1097/JTO.0b013e318274a83e
- U.S. Food and Drug Administration. Premarket Approval (PMA) - P170019. Доступно по ссылке: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=p170019. Дата обращения: 30 июня 2025 года.
- Im K, Mareninov S, Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Methods Mol Biol. 2019;1897:299-311. doi:10.1007/978-1-4939-8935-5_26
- Teixidó C, Karachaliou N, Peg V, Gimenez-Capitan A, Rosell R. Concordance of IHC, FISH and RT-PCR for EML4-ALK rearrangements. Transl Lung Cancer Res. 2014;3(2):70-74. doi:10.3978/j.issn.2218-6751.2014.02.02
- Letovanec I, Finn S, Zygoura P, et al. Evaluation of NGS and RT-PCR Methods for ALK Rearrangement in European NSCLC Patients: Results from the European Thoracic Oncology Platform Lungscape Project. J Thorac Oncol. 2018;13(3):413-425. doi:10.1016/j.jtho.2017.11.117
- Adams G. A beginner’s guide to RT-PCR, qPCR and RT-qPCR. Biochem (Lond). 2020;42(3):48-53. doi:10.1042/BIO20200034
VV-MEDMAT-127273
2025 жыл, қазан айы